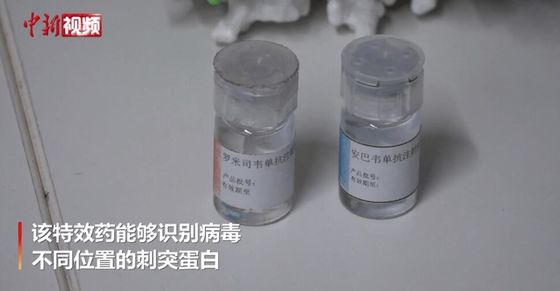
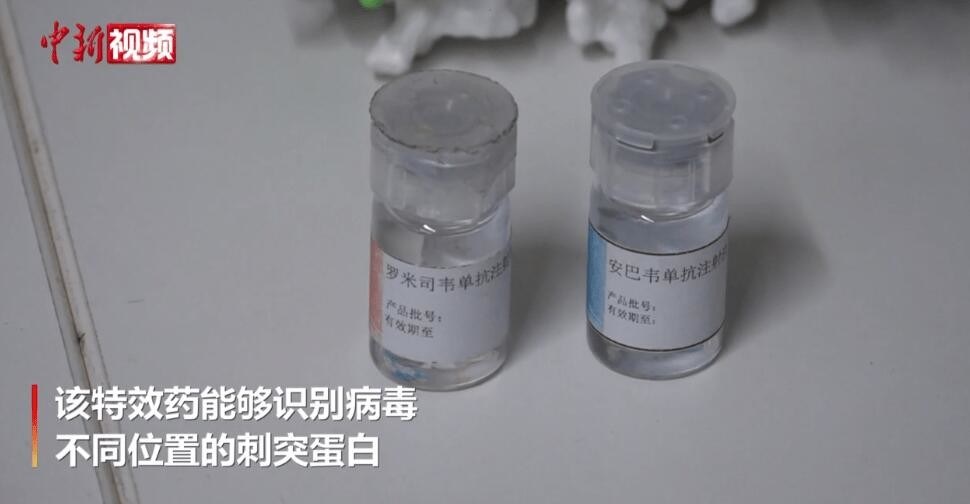
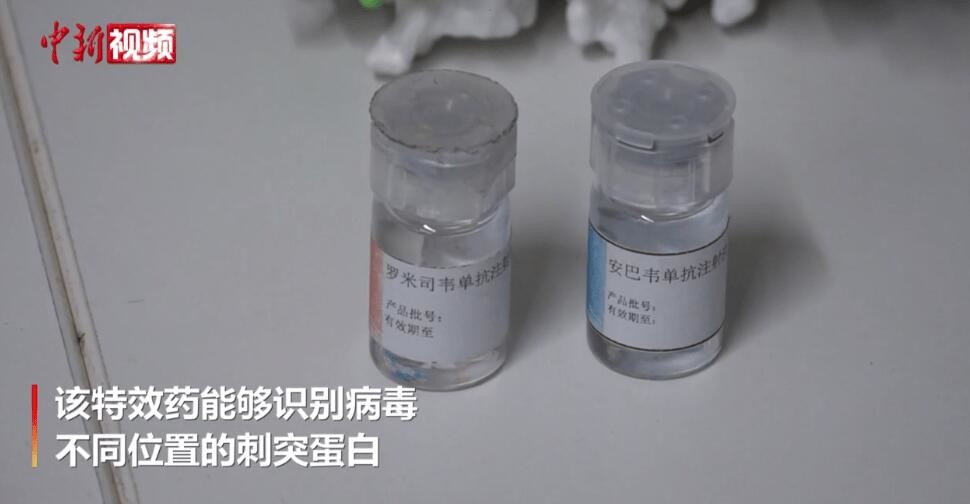
Mô tả sản phẩm
Amubarvimab / Romlusevimab (BRII-196/ BRII-198) Mô tả kháng thể đơn thân
BRII-196 và BRII-198 không cạnh tranh với SARS-CoV-2kháng thể trung hòa đơn clonalcó nguồn gốc từ bệnh nhân COVID-19 hồi phục.Các kháng thể đơn Clonal đã được thiết kế đặc biệt để giảm nguy cơ tăng cường phụ thuộc vào kháng thể và kéo dài thời gian bán hủy huyết tương để có hiệu ứng điều trị lâu dài hơn.Ngoài ra, các vùng liên kết epitope không chồng chéo của chúng cung cấp một mức độ hoạt động trung hòa cao chống lạiSARS-CoV-2Betacoronavirus.
Sự kết hợp củaBRII-196/BRII-198waNgoài sự hợp tác với NIAID, Brii Biosciences đang tiến hành các nghiên cứu bổ sung ở Trung Quốc.đánh giá dược động học và an toàn của kết hợp BRII-196/BRII-198 và nghiên cứu hiệu quả giai đoạn 2 của kết hợp BRII-196/BRII-198 để điều trị COVID-19.
Công ty xác nhận các đơn xin thuốc mới thử nghiệm đã được nộp cho liệu pháp kết hợp cho Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ.
CácCục quản lý sản phẩm y tế quốc gia Trung Quốc(NMPA) đã cấp sự chấp thuận vào ngày 9 tháng 12 năm 2021 cho sự kết hợp amubarvimab/romlusevimab (trước đây là sự kết hợp BRII-196/BRII-198)để điều trị ở người lớn và bệnh nhân nhi(trong độ tuổi 12-17 nặng ít nhất 40 kg) với loại COVID-19 nhẹ và bình thường, có nguy cơ cao tiến triển sang bệnh nặng, bao gồm nhập viện hoặc tử vong.nghiên cứu giai đoạn 3final results demonstrated a statistically significant 80% (78% in interim results) reduction of hospitalization and death with fewer deaths through 28 days in the treatment arm (0) relative to placebo (9), và cải thiện kết quả an toàn so với giả dược ở những bệnh nhân COVID-19 không nhập viện có nguy cơ cao tiến triển lâm sàng sang bệnh nặng.Tỷ lệ hiệu quả tương tự đã được quan sát ở những người tham gia bắt đầu điều trị sớm (0 - 5 ngày) và muộn (6 - 10 ngày)., sau khi các triệu chứng bắt đầu, cung cấp bằng chứng lâm sàng cần thiết trong bệnh nhân COVID-19 đã muộn điều trị.
Brii Bio(định số cổ phiếu:2137. HK) là một công ty đa quốc gia có trụ sở tại Durham, N.C., Hoa Kỳ và Bắc Kinh, Trung Quốc, phát triển các liệu pháp sáng tạo cho các bệnh có nhu cầu y tế không được đáp ứng đáng kể và gánh nặng sức khỏe cộng đồng lớn.Brii Biosciences Limited đã được bao gồm như một cổ phiếu thành phần củaHang SengChỉ số tổng hợp. tháng 10 năm 2021trình bày. Vào ngày 5 tháng 12 năm 2021, Brii Biosciences Limited đã được thêm vàoCổ phiếu Hong KongKết nối.
Amubarvimab / Romlusevimab (BRII-196/ BRII-198) Lịch sử kháng thể đơn thân
Vào đầu năm 2020, Công tyhợp tácvới Đại học Tsinghua và Bệnh viện Nhân dân thứ ba Shenzhen để thành lập TSB Therapeutics để phát triển BRII-196 và BRII-198.Amubarvimab và Romlusevimab là các kháng thể trung hòa đơn clonal không cạnh tranh với SARS-CoV-2 có nguồn gốc từ bệnh nhân COVID-19 hồi phục..
Trong vòng chưa đầy 20 tháng,Brii Bio tiến triểnsự kết hợp amubarvimab/romlusevimab từ khi phát hiện đến khi hoàn thành giai đoạn 3 phát triển dẫn đến sự chấp thuận nhanh chóng này của NMPA.Sự chấp thuận này đại diện cho sự hợp tác rất thành công với các nhà khoa học và nhà nghiên cứu lâm sàng tốt nhất ở Trung Quốc và trên toàn thế giới trên một nhiệm vụ chung, bao gồm cả Bệnh viện Nhân dân thứ 3 của Thâm Quyến và Đại học Thanh Hoa, những người đã phát hiện ra các dẫn kháng thể trung hòa này; Viện Y tế Quốc gia Hoa Kỳ, Nhóm thử nghiệm lâm sàng AIDS,người tài trợ và dẫn đầu thử nghiệm ACTIV-2.
Amubarvimab / Romlusevimab (BRII-196/ BRII-198) Chỉ định kháng thể đơn thân
BRII-196/ BRII-198 kháng thể đơn Clonal làđược chỉ rađể điều trị cho bệnh nhân không nhập viện COVID-19 có nguy cơ tiến triển lâm sàng cao.bệnh nhân nhi khoa(trong độ tuổi 12-17 nặng ít nhất 40 kg) đang được phê duyệt có điều kiện ở Trung Quốc.